近日���,沈陽農業(yè)大學動物科學和醫(yī)學學院教育部畜牧傳染病重點實驗室陳啟軍教授團隊在惡性瘧原蟲感染紅細胞的機制研究上取得了新進展����,相關研究成果已經發(fā)表在國際權威期刊《mBio》(IF=6.4、一區(qū)top期刊)上��。

惡性瘧原蟲輸出的蛋白與紅細胞膜和骨架(EMS)的相互作用���,可以導致急性寄生蟲傳染病瘧疾發(fā)生���。EMS的重塑可以將紅細胞形狀從雙凹形改變?yōu)榍蛐危绊懠毎麅鹊陌l(fā)育��、增殖以及營養(yǎng)物質和代謝物的運輸��。血影蛋白是EMS的主要成分�����,是一種長而柔韌的蠕蟲狀蛋白質�,以α-和β-血影蛋白為主要成分。惡性瘧原蟲紅細胞膜蛋白3在肌動蛋白連接復合物處結合α -血影蛋白�����,導致血影蛋白網不穩(wěn)定,惡性瘧原蟲釋放的紅細胞表面抗原也增加了血影蛋白網的孔徑�����,促進了瘧原蟲的發(fā)育��。然而��,α -血影蛋白去穩(wěn)定化的確切分子機制尚不清楚�。
磷脂酰肌醇3 -激酶( PI3K )信號通路調節(jié)除成熟紅細胞外的真核細胞中泛素- 26S蛋白酶體的激活�。惡性瘧原蟲具有完整的PI3K ( PfPI3K )信號通路,提示PfPI3K信號通路可能在惡性瘧原蟲紅細胞內發(fā)育過程中發(fā)揮重要作用���。然而���,具體的作用和機制尚不清楚。
在本研究中����,作者證明了在惡性瘧原蟲紅內期發(fā)育過程中,從環(huán)狀體到裂殖體階段���,紅內期α -血影蛋白被動態(tài)泛素化并逐漸降解�����,而β - 血影蛋白不受影響����。進一步觀察到惡性瘧原蟲磷脂酰肌醇3 -激酶( PfPI3K )在瘧原蟲紅細胞內發(fā)育過程中表達上調。
在惡性瘧原蟲發(fā)育過程中��,PfPI3K磷酸化并激活紅細胞泛素蛋白連接酶����,導致α - 血影蛋白泛素化和降解增加。進一步發(fā)現(xiàn)抑制PfPI3K的活性會影響惡性瘧原蟲在體外的發(fā)育和伯氏瘧原蟲在小鼠體內的感染性�。這些發(fā)現(xiàn)共同揭示了瘧原蟲紅內期發(fā)育過程中PfPI3K -泛素介導的α - 血影蛋白降解的重要機制。PfPI3K調控通路中的蛋白是有效治療重癥瘧疾的新靶點���。本研究加深了我們對宿主與瘧原蟲相互作用調控機制的理解�,并為新型抗瘧藥物的探索鋪平了道路�。
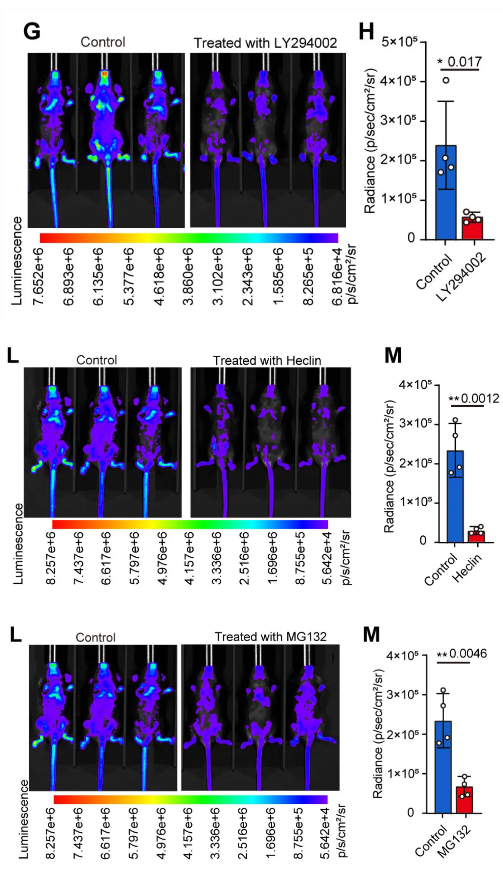
在體內藥物抑制研究中,作者使用感染伯氏瘧原蟲-Akaluc的小鼠模型����。將C57BL / 6小鼠隨機分為4組,每組10只�����,在同一天進行連續(xù)分析。每只小鼠腹腔注射1 × 10?個被寄生的紅細胞����。次日,磷脂酰肌醇3 -激酶PI3K抑制劑組小鼠每天腹腔注射LY294002 ( 1mg / kg體重) ( 39只)����。E3連接酶抑制劑組小鼠每天腹腔注射heclin ( 1mg / kg體重) ( 40只)��。在26S蛋白酶體抑制劑組中�����,小鼠每天腹腔注射MG132 ( 1.5mg / kg體重) ( 41只)�。在對照組中,小鼠每天腹腔注射生理鹽水��。
研究中使用廣州博鷺騰生物科技有限公司AniView多模式活體成像系統(tǒng)拍攝了不同抑制劑組處理后小鼠伯氏瘧原蟲受感染程度變化�����,揭示了 PfPI3K調控通路中蛋白靶點�。

論文鏈接:https://doi.org/10.1128/mbio.03510-23