近日�����,同濟大學附屬東方醫(yī)院乳腺腫瘤科主任董春燕教授課題組聯(lián)合化學科學與工程學院石碩教授課題組開展了跨學科合作研究�����,證明納米制劑可以用于三陰性乳腺癌(TNBC)的聯(lián)合治療���,針對TNBC的多種治療方式是一種創(chuàng)新的策略����。相關研究成果已發(fā)表在國際知名期刊《Small》(IF: 13.3�����,JCR1區(qū))�。

圖1|國際知名期刊《Small》(IF: 13.3,JCR1區(qū))
傳統(tǒng)的化療具有腫瘤多藥耐藥性和非靶向毒性��,不能顯著改善TNBC的預后���,且TNBC極具侵襲性和轉移性,因此�,迫切需要在TNBC治療中尋找具有獨特作用模式的治療藥物。
鐵下垂(Ferroptosis����,又名鐵死亡)是一種新的非凋亡性細胞死亡方式��,由鐵依賴的毒性過氧化脂質(Lipoid-ROS)積聚所致�。由于其在殺死癌細胞方面的有效性�����,最近受到了廣泛的關注��,但是細胞內Fe2+含量不足嚴重影響了其效果��。研究表明�,谷胱甘肽過氧化物酶4(Gpx4)也可引起鐵下垂。直接使用Gpx4抑制劑(如ML210)消耗谷胱甘肽�����,將使得Gpx4失活����,最終引起過氧化脂質(LPO)大量生成,導致細胞鐵死亡����。
博萊霉素(BLM)是一種糖肽類抗生素,與Fe2+等氧化還原活性金屬離子結合后具有獨特的抗癌活性,成為治療多種人類惡性腫瘤的有效抗癌藥物�。然而其對正常組織的高毒性,尤其是對肺的毒性����,使其在癌癥治療中的進一步臨床應用仍具有極大的挑戰(zhàn)性。
為了更好的治療TNBC�����,董春燕教授和石碩教授課題組跨學科合作研究����,提出了多種治療方式協(xié)同治療TNBC的新策略。通過將單寧酸(TA)���、BLM和Fe3+形成的金屬-酚類網(wǎng)絡與負載Gpx4抑制劑(ML210)的中空介孔普魯士藍(HMPB)納米管混合���,制備了HMPB/ML210@TA-BLM-Fe3+(HMTBF)納米復合物,以促進TNBC的鐵下垂/凋亡協(xié)同治療作用���。
實驗結果顯示�����,HMTBF可以通過增強滲透性和滯留效應(EPR)有效地靶向腫瘤區(qū)域��。腫瘤細胞內化后��,TA介導的Fe3+/Fe2+轉化可啟動Fenton反應��,使細胞內活性氧水平急劇上調�,引起LPO積累����,從而導致細胞鐵死亡,同時釋放的ML210能有效抑制Gpx4激活鐵下垂途徑的活性����。此外,F(xiàn)e2+與BLM的螯合作用導致BLM在腫瘤部位的原位毒化����,進而觸發(fā)腫瘤細胞的凋亡,與鐵下垂協(xié)同治療腫瘤�����。這些結果表明HMTBF納米制劑可作為有效的鐵下垂和凋亡誘導劑用于TNBC的聯(lián)合治療����,對TNBC的治療策略具有重要的參考意義��!
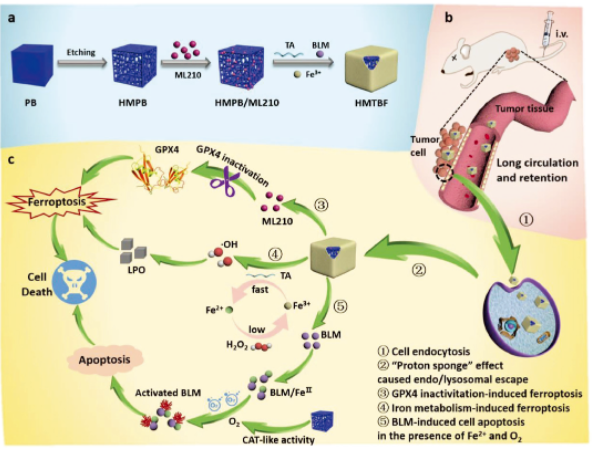
圖2|實驗方案示意圖
a)�、HMTBF納米復合物的制備
b)和c)�、腫瘤特異性ROS的產(chǎn)生、Gpx4抑制和BLM原位轉變?yōu)榛罨腂LM用于協(xié)同鐵下垂/凋亡TNBC治療
文章中����,驗證HMTBF在4T1荷瘤小鼠的生物分布和腫瘤靶向性活體實驗成像,使用了博鷺騰AniView100多模式動物活體成像系統(tǒng)拍攝���。

尾靜脈注射小鼠游離ICG及ICG-HMTBF��,并在注射后不同時間段使用AniView100獲得小鼠體內����、解剖器官和腫瘤的熒光圖像���。結果顯示ICG-HMTBF在腫瘤部位的熒光信號在注射2h后開始出現(xiàn)�,注射12h后逐漸增強并達到最大值�����,并在注射24h后仍保持較強的熒光信號(圖a,b)����,表明ICG-HMTBF在特定的腫瘤組織中蓄積增強�,滯留時間延長。相對地����,游離ICG在腫瘤部位只出現(xiàn)極弱的熒光信號,并且在12h內進一步減弱�����,表明非特異性分布的游離ICG可迅速從體內清除�。體外熒光圖像和半定量數(shù)據(jù)顯示,腫瘤部位的熒光強度約為其他器官的3.7-162.2倍(圖c�,d),說明HMTBF對腫瘤組織有明顯的富集作用���。此外��,HMTBF注射4h后在腫瘤內的分布為9.9%ID/g��,注射12h后達最大值���,為典型的EPR效應所致��。同時�����,由于網(wǎng)狀內皮系統(tǒng)的捕獲����,HMTBF也分布在肝臟和脾臟����。
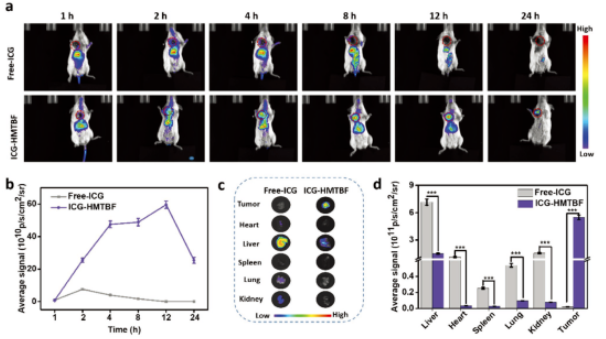
圖3|HMTBF的體內外分布情況
a)、ICG和ICG-HMTBF靜脈給藥后在小鼠體內的分布情況��,紅色圓圈代表腫瘤
b)��、腫瘤組織在不同時間點的熒光強度
c)�����、解剖器官和腫瘤在12h的典型熒光圖像
d)���、半定量分析解剖的臟器和腫瘤組織在12h的熒光強度���。
論文鏈接:https://doi.org/10.1002/smll.202103919.