【文獻速遞】基于細胞外囊泡的新型納米材料通過 Let-7a 誘導舌鱗癌細胞凋亡
2023-03-24 13:40:29
近日����,吉林大學動物科學學院實驗動物中心王東旭教授課題組與吉林大學口腔醫(yī)院口腔頜面外科劉煒煒教授課題組在細胞外囊泡與舌鱗狀細胞癌關系研究領域取得了新的進展。相關研究成果已發(fā)表在國際知名期刊《Frontiers in Bioengineering and Biotechnology》(IF:5.89�,JCR 2區(qū))。

圖1|國際知名期刊《Frontiers in Bioengineering and Biotechnology》(IF:5.89��,JCR 2區(qū))
近年來���,針對舌鱗狀細胞癌(TSCC)的治療和診斷已取得了進展�,但 5 年生存率仍然很低���。治療TSCC的方法主要為手術�、放療和化療��。在過去幾十年中�,中醫(yī)藥在癌癥研究方面已被廣泛應用。例如���,從蜂蜜中提取的白楊素可以通過非編碼RNA在多種癌細胞中誘導細胞凋亡并抑制增殖�����。并且�����,納米結構也已被廣泛研究用于癌癥治療中的藥物遞送和診斷�����,例如金納米粒子 (AuNPs)�。
細胞外囊泡(EVs)是由細胞釋放到細胞外環(huán)境中的小囊泡。EVs 由脂質雙層膜組成�����,該膜包裹著小的無細胞器的細胞質�����,EVs 的攝取特定于細胞類型�。
但白楊素與金納米粒子在單獨運用時對癌癥缺乏特異性,有證據(jù)表明���,納米粒子與 EVs結合可作為靶向癌細胞的藥物載體。因此�����,納米材料與 EVs 結合可以提高癌癥治療的效率。
為了探究該方法���,王東旭教授與劉煒煒教授團隊首先使用白楊素治療 TSCC 細胞和分離的 EVs-白楊素�。然后將四氯金酸(HAuCl4)與 EVs-白楊素一同孵育形成 Au-EVs�����。在 EVs-Con 和 EVs-chrysin 之間進行轉錄組測序篩選后�����,對 let-7a 家族進行了分析��。該研究結果表明��,Au-EVs 通過TSCC中的 let-7a 誘導細胞凋亡����。
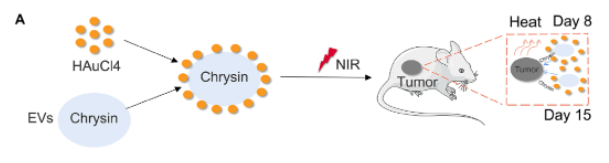
圖2 |實驗方案示意圖
文章中,研究 Au-EVs在體內的抗腫瘤作用的實驗使用了博鷺騰AniView600多模式動物活體成像系統(tǒng)拍攝觀察����。

在該實驗中��,首先將SCC9 細胞注射到裸鼠體內��。7天后��,將Au-EVs注射到腫瘤下方�����,并在第8天和第15天用近紅外光照射裸鼠并進行腫瘤生長分析�。結果表明���,Au-EVs具備腫瘤靶向性�,且熒光強度隨時間增加而增加���。此外���,近紅外輻射可以淬滅 Au-EVs 的熒光。在第21天時收集腫瘤���,與預期結果相符�����,Au-EVs 與 NIR 結合顯著抑制了腫瘤生長���,并且沒有改變體內其他器官。
這些結果表明�,Au-EVs 有效地介導了等離子光熱療法(PPT)并抑制了體內腫瘤的生長。
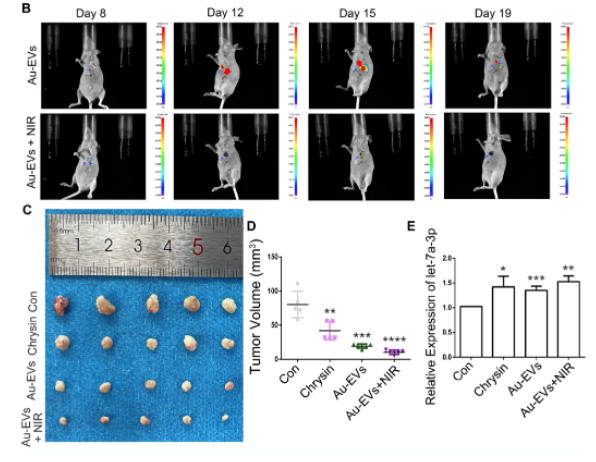
本研究發(fā)現(xiàn)���,Au-EVs作為一種新型納米材料����,在SCC9 細胞中具有吸收特異性�。在經過近紅外輻射后,Au-EVs 能夠有效增強細胞凋亡���。通過RNA-seq,篩選 EVs-chrysin miRNA,Let-7a-3p����,并且過表達let-7a-3p會誘導細胞凋亡��,此結果表明經NIR 處理的 Au-EV 顯著抑制了體內腫瘤的生長�����。
本研究發(fā)現(xiàn),Au-EVs作為一種新型納米材料�,在SCC9 細胞中具有吸收特異性。在經過近紅外輻射后��,Au-EVs 能夠有效增強細胞凋亡��。通過RNA-seq,篩選 EVs-chrysin miRNA,Let-7a-3p��,并且過表達let-7a-3p會誘導細胞凋亡����,此結果表明經NIR 處理的 Au-EV 顯著抑制了體內腫瘤的生長。
綜上所述����,本研究結果提供了一種能夠提高 AuNPs 靶向性的納米材料,并且該材料可能與針對 TSCC 的最佳療法相關����。
論文鏈接:doi: 10.3389/fbioe.2021.766380