近日����,湘雅二醫(yī)院藥學部湖南省轉(zhuǎn)化醫(yī)學與創(chuàng)新藥物工程技術研究中心向大雄教授團隊在納米醫(yī)學領域取得系列研究成果,在國際知名期刊《Advanced Healthcare Materials》(IF=9.93�,JCR1區(qū))及《Journal of Controlled Release》(IF=9.77,JCR1區(qū))上連續(xù)發(fā)表兩篇研究性論文����。
兩篇論文第一作者及通訊作者單位均為中南大學湘雅二醫(yī)院,向大雄教授為通訊作者���,團隊2018級博士研究生吳軍勇���、2019級博士研究生李泳江為共同第一作者���。
文章一

圖1|國際知名期刊《Advanced Healthcare Materials》(IF=9.93,JCR1區(qū))
三陰性乳腺癌含有致密的腫瘤基質(zhì)���,是藥物滲透和細胞毒性T淋巴細胞浸潤的主要障礙�,因此化療和免疫治療通常難以發(fā)揮作用�。
研究發(fā)現(xiàn)中性粒細胞彈性蛋白酶能快速破壞致密的細胞外基質(zhì),克服腫瘤基質(zhì)屏障�,使藥物或免疫細胞進入腫瘤內(nèi)部發(fā)揮作用。然而游離的彈性蛋白酶缺乏靶向性�,因此向大雄教授團隊開發(fā)了嵌合腫瘤細胞膜蛋白的仿生脂質(zhì)體(LMP),并在表面結(jié)合彈性蛋白酶(NE-LMP)���,利用腫瘤細胞膜蛋白同源靶向及滲透與滯留效應(EPR)可以有效將NE靶向至小鼠原位乳腺癌內(nèi)部并降解腫瘤基質(zhì)����。與紫杉醇及與PD-1免疫檢查點抑制劑聯(lián)合應用表現(xiàn)出顯著增強的化學-免疫協(xié)同療效����,顯著延長了小鼠的生存期���。同時,這一聯(lián)合應用策略還可以明顯抑制腫瘤肺轉(zhuǎn)移�。
文章中,標記DiR的NE-LMP在原位乳腺荷瘤小鼠中的生物分布和腫瘤靶向作用的活體實驗成像��,使用了廣州博鷺騰AniView100多模式動物活體成像系統(tǒng)拍攝��。

活體結(jié)果顯示DiR標記的NE-LMP在給藥后很快到達腫瘤部位(2小時)����,并在8小時積累最多;體外器官結(jié)果顯示DiR標記的NE-LP也到達腫瘤部位��,但熒光強度不如DiR標記的NE-LMP����,證明了NE-LMP的優(yōu)越腫瘤靶向作用���。
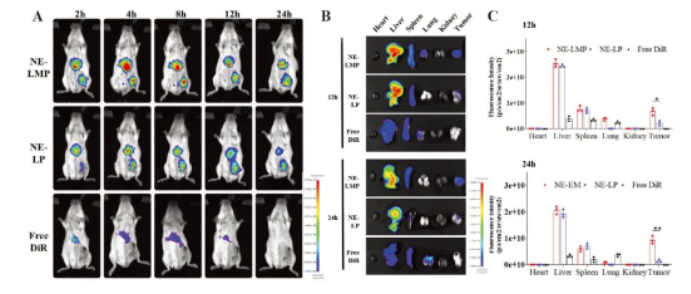
圖2|NE-LMP的生物分布
(A) NE-LMP和NE-LP的體內(nèi)生物分布和腫瘤靶向作用
(B) NE-LMP和NE-LP的體外生物分布
(C) 體外組織中熒光強度的量化
目前上市用于臨床的納米載體大部分是脂質(zhì)體����,向大雄教授團隊利用簡單易制備的脂質(zhì)體作為核心,表面嵌合特殊功能蛋白���,這是一種“自下而上”的組裝思路���,具有前沿的創(chuàng)新性和實用性。
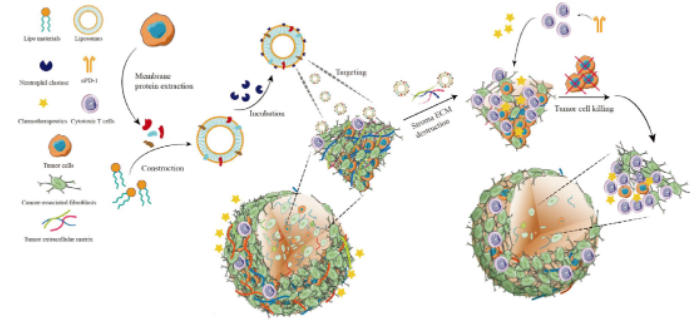
圖3|用于增強腫瘤化學免疫治療的膜蛋白彈性蛋白酶結(jié)合仿生脂質(zhì)體的制備示意圖
文章二

圖4|國際知名期刊《Advanced Healthcare Materials》(IF=9.93���,JCR1區(qū))
多形性膠質(zhì)母細胞瘤(GBM)是惡性程度最高的腦部腫瘤�����,目前缺乏有效的治療方式�����,常規(guī)的化療藥物難以跨越血腦屏障(BBB)發(fā)揮作用�。
外泌體(Exos)是由細胞分泌����,粒徑在30-150nm的納米囊泡,作為藥物載體具有多種優(yōu)勢�。腦微血管內(nèi)皮細胞是BBB主要組成成分,其分泌的外泌體可以跨越BBB�����,用其載藥可以將藥物遞送至腦內(nèi)。
然而��,Exos提取純化過程較為繁瑣�����,產(chǎn)量較低�����,作為藥物載體極大限制了應用�。為了彌補這一缺陷,向大雄教授團隊采用連續(xù)擠壓細胞的方式生產(chǎn)仿生納米囊泡(BNVs)����,其具有與Exos相似的粒徑、外觀和蛋白表達���。
本研究將Exos和BNVs進行深入比較,在腦部腫瘤的藥物遞送中進行了直接對比��。結(jié)果表明�,來源于腦微血管內(nèi)皮細胞的BNVs是天然Exos的合格替代品。二者的載藥能力相似,但BNVs的產(chǎn)率是Exos的500倍���。攜帶阿霉素的天然Exos和BNVs在斑馬魚和體內(nèi)皮下/原位異種移植小鼠腫瘤模型中表現(xiàn)出良好的抑瘤作用���。
文章中,評估和比較Exos和BNVs在小鼠腫瘤模型中腦腫瘤靶向能力的活體實驗成像�����,使用了廣州博鷺騰AniView100多模式動物活體成像系統(tǒng)拍攝�。

尾靜脈對原位GBM小鼠注射給予DiR標記的Exos、BNVs或游離DiR�����,并在注射后6小時����、12小時和24小時使用AniView100拍攝獲得小鼠體內(nèi)和體外器官熒光圖像。結(jié)果顯示DiR標記的Exos和BNVs在6小時達到GBM����,并在24小時積累更多,而游離DiR在大腦中沒有顯示熒光信號��,表明Exos和BNVs都可以突破BBB并靶向大腦中的腫瘤部位。
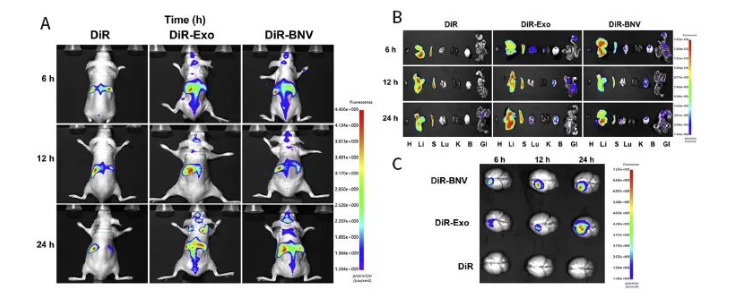
圖5|Exos和BNVs的生物分布和腫瘤靶向作用
(A) Exos和BNVs在GBM小鼠中的體內(nèi)生物分布(n=3)
(B) Exos和BNVs在原位GBM小鼠中的體外生物分布(n=3)���。H:心臟�����;S:脾��;K:腎臟����;B:大腦�����;GI:胃腸道
(C) 原位GBM小鼠中Exos和BNVs的腦分布(n=3)
鑒于自體來源的BNVs的低免疫原性����、高產(chǎn)量等特性,可將其作為納米醫(yī)學中有效的Exos替代物�,以克服Exos制劑研究過程中難以擴大生產(chǎn)的缺陷。
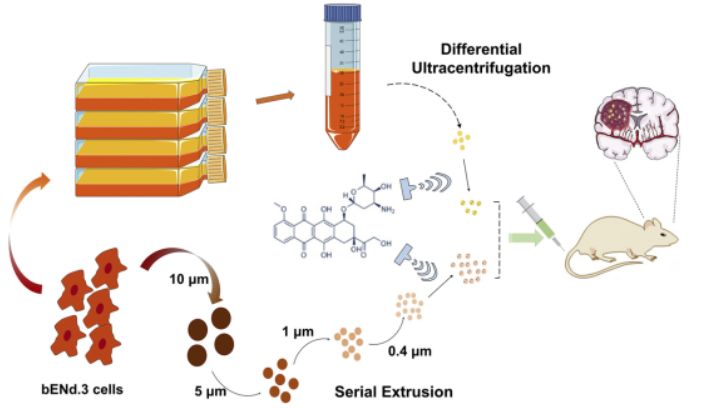
圖6|文章圖形概要
惡性腫瘤是嚴重危害人類健康的重大疾病�����,近年來��。發(fā)病率和死亡率逐年上升���,而臨床常規(guī)的治療方式(化療��、放療�、免疫治療)特異性差����,毒副作用較大,使用常受到限制����。
精心設計的納米載體可以實現(xiàn)腫瘤的精準靶向,用以調(diào)控腫瘤的微環(huán)境或殺滅腫瘤細胞�����,達到減毒增效���,然而常規(guī)的有機或無機納米載體屬于外源性材料��,常引起機體的免疫響應����,易被吞噬而失去效果。
鑒于此���,向大雄教授團隊近年來著眼于仿生納米遞藥系統(tǒng)研究�,設計了一系列以外泌體����、囊泡、細胞膜和蛋白等內(nèi)源性材料為基礎的納米載體���,實現(xiàn)了腫瘤的精準治療�。
文獻鏈接:
https://doi.org/10.1016/j.jconrel.2021.07.004
https://doi.org/10.1002/adhm.202100794