近日�����,同濟大學醫(yī)學院-納米院李永勇教授團隊在納米醫(yī)學領域取得新的研究成果����,在國際知名期刊《Biomaterials》(IF=12.479��,JCR1區(qū))上發(fā)表研究性論文。

圖1|國際知名期刊《Biomaterials》(IF=12.479����,JCR1區(qū))
新抗原長肽疫苗(NeoVax)具有擴大和拓寬腫瘤特異性細胞毒性T淋巴細胞(CTL)反應的潛力��,成為對抗多種腫瘤類型的希望���。然而����,外源抗原會被體內的內溶酶體捕獲���,進而限制在抗原提呈細胞(APCs)中的胞漿遞送�,導致抗原的交叉呈遞效率低下�����,無法對癌癥進行有效的CTL反應�����。研究表明�,獲得性免疫系統(tǒng)可以通過激活NADPH氧化酶2(NOX2)復合體產(chǎn)生脂質氧化作用��,使得外源抗原逃逸內溶酶體�,進而賦予APCs促進外源抗原交叉呈遞的能力��。但是�,NOX2激活的確切機制尚不清楚,阻礙了安全有效的干預策略的發(fā)展�。
受NOX2機制的啟發(fā),李永勇教授團隊設計了一種名為NVscp的生物礦化納米疫苗�。NVscp通過在模型抗原卵清蛋白(Ova)自組裝的納米疫苗(Nvs)上原位生長過氧化鈣而發(fā)展起來,具有超高的Ova抗原密度����,并含有必要的過氧化鈣佐劑(8.9%)。過氧化鈣佐劑響應內溶酶體的酸性環(huán)境����,觸發(fā)ROS的釋放,進而形成脂質氫過氧化物�,導致內溶酶體脂質過氧化。因此�����,NVscp被賦予內溶酶體逃逸能力����,以實現(xiàn)抗原交叉提呈的胞漿轉運����。體內實驗表明����,NVscp的大小可以有效地滯留在引流淋巴結(dLNs)中�,從而增強不同的APCs(特別是髓竇巨噬細胞(MSMs,F(xiàn)4/80+CD169+))和樹突狀細胞(DCs���,CD11c+F4/80-)的抗原交叉提呈���,有效地促進腫瘤特異性CD8+CTL和CD4+T輔助細胞(Th1細胞)的激活,用于癌癥免疫治療��。

圖2|NVscp的形成和NVscp誘導腫瘤免疫治療機制的示意圖
文章中��,評估NVscp在小鼠體內淋巴結的累積活體實驗成像��,使用了AniView100多模式動物活體成像系統(tǒng)拍攝����。

于小鼠關節(jié)皮下注射FITC標記的NVs和NVscp��,在不同時間點采集腹股溝淋巴結(ILNs)熒光信號��。結果顯示Hock注射4h后���,NVs和NVscp在病灶內迅速積累,兩組熒光信號強度無差異��。然而����,NVs的熒光在注射24h后迅速減弱。對兩組熒光信號強度定量分析���,顯示NVscp組的抗原積累大約是NVs組的2.8倍���,猜測NVscp的積累增強可能與過氧化鈣有效修飾后納米疫苗的物理化學性質(表面電荷和組成)的改變有關。
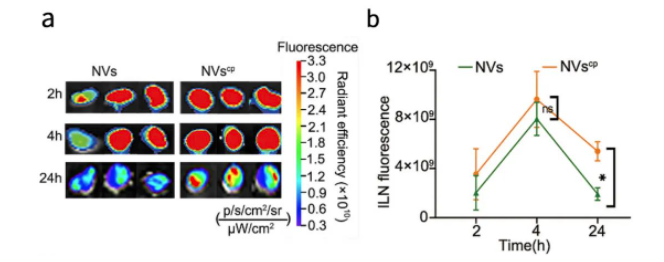
圖3|NVscp在小鼠體內淋巴結累積的情況
a��、注射后2�、4和24小時解剖ILNs的體外熒光圖像
b、對皮下注射后不同時間點ILNs的熒光強度進行量化���,來測量疫苗動力學
長期以來��,癌癥嚴重威脅人類健康和生命安全���,在治療癌癥的過程中����,疫苗發(fā)揮了舉足輕重的作用���?���;诖蠖鄶?shù)蛋白質/多肽結構都含有促進鈣生物礦化的羧基���,受NOX2機制的啟發(fā),李永勇教授團隊構建了一種有前途的技術手段����,用于改善各種癌癥疫苗模式的交叉呈現(xiàn),包括多肽和蛋白質疫苗等無細胞平臺�。考慮到它的方便性�、有效性和生物相容性,未來可能被廣泛應用于癌癥治療�。
參考文獻:https://doi.org/10.1016/j.biomaterials.2021.121089