前列腺癌(Prostate cancer, PCa)是男性最常見的腫瘤之一��。對于局部晚期和轉(zhuǎn)移性前列腺癌�����,雄激素去勢治療最初有效���,但最終會發(fā)展為耐去勢���,導(dǎo)致治療效果差,死亡率高�����。紫杉醇(Docetaxel, DTX)�,一種紫杉烷類藥物�,已被證實可以延長總生存期的標(biāo)準(zhǔn)化療藥物;然而�,因為耐藥性和嚴重的副作用,限制了其在癌癥化療中的應(yīng)用���。因此�,需要開發(fā)生物相容的藥物釋放平臺以減少目前化療的全身副作用,提高抗癌效果�����。
隨著納米藥物的發(fā)展���,利用腫瘤微環(huán)境響應(yīng)性的載藥納米傳遞系統(tǒng)已成為一種很有前途的腫瘤化療策略��。腫瘤細胞相比正常細胞�,會產(chǎn)生更高水平的活性氧(Reactive oxide species, ROS)����,具有活性氧響應(yīng)性功能基團(如草酸酯鍵、硫酮)的載藥納米顆粒在腫瘤細胞中可以發(fā)生化學(xué)結(jié)構(gòu)的變化�����,進而觸發(fā)藥物釋放�����;同樣��,腫瘤細胞中的谷胱甘肽(Gltathione����,GSH)水平比細胞外基質(zhì)高出1000倍�����,含有二硫鍵(Disulfide bonds, SS)的谷胱甘肽反應(yīng)性載藥納米顆粒也能在腫瘤細胞內(nèi)優(yōu)先釋放藥物�。目前已有載藥納米顆粒被開發(fā)出來同時對ROS和GSH做出反應(yīng)���,這為PCa化療設(shè)計無毒�、雙重響應(yīng)性納米顆粒具有重要的參考意義��。
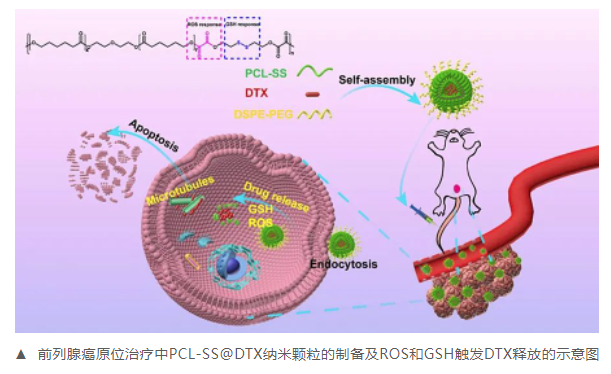
近日�����,中山大學(xué)附屬第七醫(yī)院腎泌尿外科中心龐俊教授課題組針對腫瘤細胞中豐富的ROS和GSH�,成功地設(shè)計并開發(fā)了一種獨特的雙響應(yīng)納米載體(PCL-SS)用于DTX的傳遞和前列腺癌的治療��。負載DTX的PCL-SS納米顆粒不僅在正常生理環(huán)境中穩(wěn)定�,而且能迅速觸發(fā)前列腺癌細胞釋放DTX。體外實驗表明����,PCL-SS@DTX納米顆粒具有良好的生物相容性���,對前列腺癌細胞有較強的細胞毒作用,能抑制細胞遷移和侵襲�����,并誘導(dǎo)細胞凋亡����。在荷前列腺癌小鼠體內(nèi),PCL-SS@DTX納米顆?����?稍谠荒[瘤部位蓄積�,通過抑制前列腺癌細胞增殖和誘導(dǎo)細胞凋亡而顯著抑制腫瘤生長,且對主要器官無明顯損傷����。有理由相信,這種雙響應(yīng)性納米給藥系統(tǒng)可能為前列腺癌化療提供一種有前途的治療選擇��。相關(guān)成果已發(fā)表在國際知名期刊《Materials Science and Engineering: C》����。
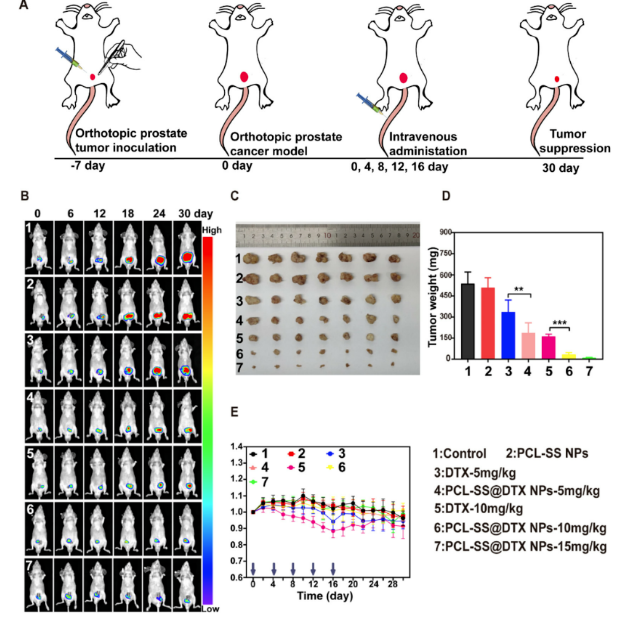
▲ 不同藥物組對原位前列腺癌的體內(nèi)抗癌作用�����。
(A)����、實驗計劃和實施的時間表���。
(B)��、使用博鷺騰AniView100拍攝的DU145荷瘤小鼠經(jīng)不同藥物組處理后的體內(nèi)生物發(fā)光圖像�����。
(C)和(D)為各組前列腺腫瘤組織的照片和重量��。
(E)�、不同藥物組小鼠體重變化��,箭頭表示靜脈給藥的時間點�。
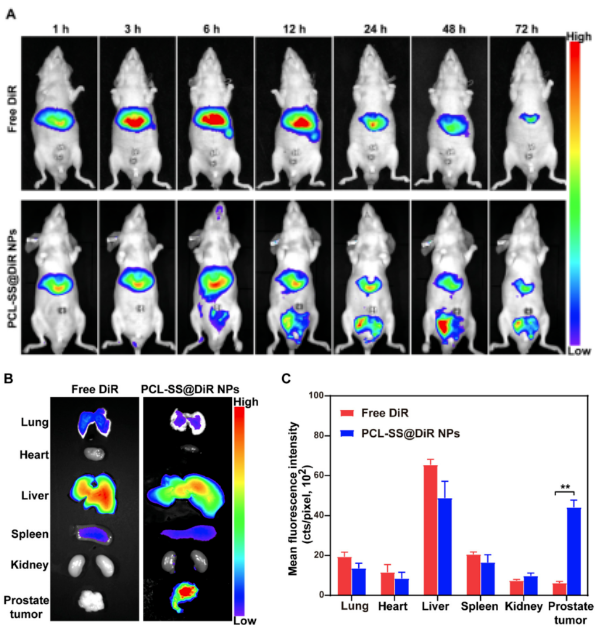
▲ 使用博鷺騰AniView100拍攝的游離DiR和PCL-SS@DiR納米顆粒在DU145前列腺原位移植瘤小鼠體內(nèi)的熒光分布圖�。
(A)、DU145荷瘤小鼠靜脈注射游離DiR和PCL-SS@DiR納米顆粒后的體內(nèi)熒光圖像�。
(B)��、靜脈注射24小時后主要器官和腫瘤組織的體外熒光圖像�。
(C)���、主要器官和腫瘤組織的熒光強度的定量分析���。

參考文獻:
[1] Lzab C, et al. Reactive oxygen species and glutathione dual responsive nanoparticles for enhanced prostate cancer therapy[J]. Materials Science and Engineering: C, 2021.