近日�,重慶陸軍軍醫(yī)大學(xué)西南醫(yī)院病理科&西南癌癥中心研究所卞修武院士和王巖教授研究團(tuán)隊(duì)在膠質(zhì)母細(xì)胞瘤(Glioblastoma,GBM)的治療策略方面取得了新的進(jìn)展�,相關(guān)研究成果已發(fā)表在Nature子刊“Signal Transduction and Targeted Therapy”(IF= 18.005,JCR1)。

△ 圖1
Nature子刊《Signal Transduction and Targeted Therapy》(IF:18.187,JCR 1區(qū))
膠質(zhì)瘤是最常見的腦腫瘤����,2016年世界衛(wèi)生組織(World Health Organization,WHO)將其分為四級(I-IV)�。數(shù)字越大,惡性程度越高��,預(yù)后越差����,其中,GBM屬于IV級�。GBM惡性程度高、侵襲性強(qiáng)�����,患者的平均生存期約為15個(gè)月��,5年生存率不到5%��,因此��,探究GBM的發(fā)生����、發(fā)展機(jī)制,尋找復(fù)發(fā)相關(guān)的分子標(biāo)志物��,針對相關(guān)靶點(diǎn)進(jìn)行轉(zhuǎn)化研究��,具有重要的意義�����。
在臨床上�����,大多數(shù)GBM患者(約90%)被診斷為野生型IDH1/2��,定義為原發(fā)或新發(fā)的GBM�����;大約10%的GBM患者攜帶IDH1/2突變�����,定義為繼發(fā)性GBM����。根據(jù)癌癥基因組圖譜計(jì)劃(The Cancer Genome Atlas,TCGA)中腦膠質(zhì)瘤基因轉(zhuǎn)錄組�,可以將GBM分為4種亞型:前神經(jīng)元型、神經(jīng)元型�����、經(jīng)典型��、間質(zhì)型���。經(jīng)典型以EGFR基因擴(kuò)增/突變?yōu)樘卣?��,前神?jīng)元型主要表現(xiàn)為PDGFRA(Platelet-derived growth factor receptor α)突變或IDH1/2 突變,間質(zhì)型主要存在神經(jīng)纖維蛋白1(Neurofibromatosis type 1���,NF1 )突變��。
血小板衍生生長因子受體α(PDGFRA) 和受體β(PDGFRB) 屬于受體酪氨酸激酶(Receptor tyrosine kinase�����,RTK)家族�����,并作為血小板衍生生長因子(Platelet-derived growth factor���,PDGF)的受體發(fā)揮作用���。哺乳動(dòng)物中的四種 PDGF 基因(PDGFA���、PDGFB、PDGFC 和 PDGFD)分別編碼四種肽(PDGFA��、PDGFB��、PDGFC 和 PDGFD),它們形成五種功能同源或異源二聚體:PDGF-AA�����、PDGF- AB�、PDGF-BB�、PDGF-CC 和 PDGF-DD�。
研究發(fā)現(xiàn)PDGFA 和 PDGFRA 在膠質(zhì)瘤發(fā)生和進(jìn)展中起關(guān)鍵作用。實(shí)驗(yàn)也表明����,PDGFA 和 PDGFRA 的過表達(dá)成功地誘導(dǎo)了小鼠模型中GBM的發(fā)育,這些結(jié)果表明PDGFRA 在GBM中的關(guān)鍵作用���,并將 PDGFA/PDGFRA 軸確定為 GBM 的潛在治療靶點(diǎn)��。
雖然已經(jīng)開發(fā)出幾種針對 PDGFRA 的抗腫瘤藥物,體外和體內(nèi)的數(shù)據(jù)也支持靶向PDGFRA對GBM細(xì)胞的有效抑制作用�����,然而�����,單一PDGFRA抑制劑的臨床試驗(yàn)均未顯示出抗腫瘤作用��。
基于上述背景��,研究人員對GBM 中 PDGFA 和 PDGFRA 的調(diào)控機(jī)制進(jìn)行了詳細(xì)研究����。首先開展的實(shí)驗(yàn)數(shù)據(jù)表明,PDGFRA 的活性或表達(dá)缺陷并沒有有效地阻斷PDGFA活性��,所以推測PDGFRA 可能不是 PDGFA 功能所必需的���。
為了分析參與 PDGFA 功能的蛋白質(zhì)��,研究人員進(jìn)行了免疫共沉淀 (Co-IP) 和質(zhì)譜 (MS)實(shí)驗(yàn)�,并首次描繪了 PDGFA 相關(guān)蛋白網(wǎng)絡(luò)�。令人驚訝的是,實(shí)驗(yàn)結(jié)果表明�����,即使沒有激活 PDGFRA 和 AKT�����,EPHA2 也可以被 PDGFA 暫時(shí)激活��。此外�����,MS、Co-IP����、體外結(jié)合熱力學(xué)(In vitro binding thermodynamics)和鄰近連接實(shí)驗(yàn)(Proximity ligation assay)都一致地證明了EPHA2與PDGFA的相互作用,EPHA2的高表達(dá)導(dǎo)致 TCGA-GBM 數(shù)據(jù)庫和臨床 GBM 樣本中 PDGF 信號靶標(biāo)的上調(diào)�����。
由于 PDGFA 誘導(dǎo)的 EPHA2 活化���,通過抑制劑阻斷 PDGFRA 不能有效抑制 GBM細(xì)胞的增殖��,但同時(shí)抑制 EPHA2 和 PDGFRA后�,在體外和體內(nèi)的實(shí)驗(yàn)結(jié)果都顯示出對GBM 細(xì)胞的協(xié)同抑制作用����。因此,靶向PDGFRA 和 EHA2的雙重抑制劑有望作為未來GBM的治療新策略��。
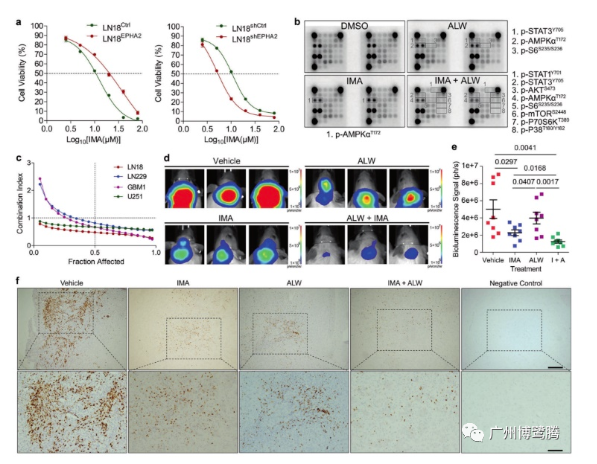
△ 圖2
PDGFRA和EPHA2聯(lián)合抑制對GBM細(xì)胞的協(xié)同抑制作用�。
a、MTT實(shí)驗(yàn)測量過表達(dá)EPHA2(左)或敲低EPHA2(右)的LN18細(xì)胞的IC50����。
b�����、抗體陣列分析載體、EPHA2抑制劑(ALW)和PDGFRA抑制劑(IMA)處理的LN18細(xì)胞���,顯著變化的蛋白質(zhì)用框架標(biāo)記并單獨(dú)列出�����。
c�����、MTT實(shí)驗(yàn)評價(jià)聯(lián)合藥物在四種GBM細(xì)胞株的作用�����。
d��、載體�����、IMA��、ALW 或 IMA + ALW 處理過的 U251 細(xì)胞原位生長的代表性圖像(使用博鷺騰AniView100多模式動(dòng)物活體成像系統(tǒng)拍攝)���。
e�����、生物發(fā)光信號強(qiáng)度繪制的腫瘤大小統(tǒng)計(jì)圖����。
f��、載體��、IMA����、ALW或IMA+ALW治療的小鼠原位GBM腫瘤組織切片上Ki67的代表性免疫組織化學(xué)圖像。
論文鏈接https://www.nature.com/articles/s41392-021-00855-2